نکات مهم آزمایشگاهی در آزمایشهای تشخیص دیابت
سنجش C-Peptide:
از مهمترین کاربردهای اندازهگیری C-Peptide بررسی هایپوگلیسمی در صبح ناشتا، تومورهای سلولهای بتا، طبقهبندی دیابت، پیوند پانکراس و جراحی موفقیتآمیز برداشت لوزالمعده است. در افرادی که بهطور مصنوعی با تزریق انسولین دچار هایپوگلیسمی میگردند مقدار C-Peptide نرمال ولی مقدار انسولین بالا اســت، زیرا C-Peptide در انسولینهای تجارتی وجود ندارد.
آنتیبادیهای ضد انسولینی و یا انسولین منبع خارجی در سنجش C-Peptide واکنش نشان نمیدهند. متابولیسم کبدی C-Peptide ناچیز و ازاینرو پارامتر بهتری برای ارزیابی فعالیت سلولهای بتا است. سنجش C-Peptide، تخمینی از ظرفیت و سرعت ترشح انسولین است؛ برای مثال در بیماران دیابتی چنانچه میزان آن پس از تحریک با گلوکز یا گلوکاگون بیشتر از ۱,۸ ng/ml (۰.۶ nmol/l) گردد، بیماری شبیه دیابت تایپ دو از نظر بالینی است و چنانچه مقدار آن کمتر از ۰.۵ ng/ml (<۰.۱۶nmol/l) گردد شبیه به دیابت تایپ یک است. سطح C-Peptideصبح ناشتا در افراد سالم ۱/۸۹-۰/۷۸ ng/ml و سطح آن با تحریک گلوکز یا گلوکاگون بین ۵/۶۴-۲/۷۳ است که حدود ۳ تا ۵ برابر سطح قبل از تحریک است. سطح ادراری C-Peptide در طیف ۲۶±۷۴ ug/l قرار میگیرد.
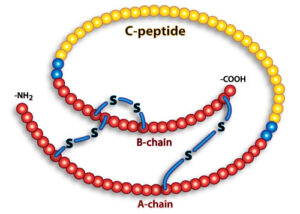
پروانسولین در گرانولهای ترشحی ساختمان گلژی انبار شده و شکستن آنزیمی آن موجب رها شدن انسولین و پپتید C به گردش خون میگردد
انسولین:
انسولین از سلولهای بتای پانکراس ترشح میشود و اولین هورمون در تعیین سکانس سنجش با رادیو ایمونواسی و سنتز نوترکیبی تکنولوژی DNA است. انسولین یک هورمون آنابولیک و محرک برداشت گلوکز از خون، تسهیلکننده تبدیل گلوکز به گلیکوژن، بازدارنده تولید گلوکز از کبد و محرک پروتئینسازی و بازدارنده تخریب پروتئین است.
انسولین انسانی دارای ۵۱ اسیدآمینه در دو زنجیره آلفا و بتا با پیوند دیسولفیدی است و سکانس پایانی کربوکسیلی آن B۲۳-۲۶ که برای عملکرد بیولوژیکی آن اساسی است برای هرگونه کاملاً محافظت شده است. انسولین بهصورت Preproinsulin با حدود ۱۰۰ اسیدآمینه در سلولهای بتای لوزالمعده ساخته میشود. فرم Prepro در شرایط طبیعی در خون یافت نمیشود زیرا بهسرعت به پروانسولین تبدیل میگردد.
پروانسولین در گرانولهای ترشحی ساختمان گلژی انبار شده و شکستن آنزیمی آن موجب رها شدن انسولین و پپتید C به گردش خون میگردد. در افراد سالم انسولین بهصورت نبضی(pulsatile) ترشح میگردد. فاز اول آن در یک تا دو دقیقه از تجویز وریدی قند با ترشح انسولین ذخیره شروع شده و تا ۱۰ دقیقه ادامه مییابد. فاز دوم پس از پایان فاز اول شروع شده و تا ۶۰ الی ۱۲۰ دقیقه تا نرمال شدن قند خون ادامه مییابد. با نارسا شدن سلولهای بتا، ترشح نبضی ناپدید گردیده، درحالیکه فاز دوم در اکثر بیماران دیابتی تایپ دو به فعالیت ادامه میدهد. فاز دوم بستگی به تداوم توانایی سنتز انسولین دارد. نیمهعمر انسولین ۴ تا ۵ دقیقه است. پروانسولین دارای ۱۰ درصد فعالیت انسولین است و نیمهعمر آن ۳۰ دقیقه است. با وجودی که انسولین و پپتید C بهصورت هممولار ترشح میشوند ولی تراکم پپتید C حدود ۵ تا ۱۰ برابر بیشتر از انسولین به علت نیمهعمر حدود ۳۵ دقیقهای آن است. پپتید C از کلیه پاکسازی میشود.
اکثر بیماران مبتلا به تومورهای بدخیم سلولهای بتا دارای غلظت بالا از انسولین، پروانسولین و پپتید C در خون هستند ولی بهندرت ممکن است تنها پروانسولین افزایش داشته باشد زیرا ممکن است تبدیل پروانسولین به انسولین در بافت توموری انجام نشود. غلظت پروانسولین در مبتلایان به دیابت تایپ دو افزایش داشته و همراه با ریسک حوادث قلبی عروقی است، از طرف دیگر در دیابت بارداری نیز سطح پروانسولین افزایش مییابد. افزایش پروانسولین در نارسایی مزمن کلیه، سیروز کبدی و پرکاری تیروئید نیز ممکن است مشاهده شود. سنجش سطح پروانسولین به علت تداخل انسولین و پپتید C مشکل است، مگر اینکه از سرم بیمار نخست عوامل مداخلهگر برداشت شود، سطح قابل تشخیص آن ۰,۲۵ pmol/l است.
پاتولوژی دیابت نوع یک:
دیابت نوع یک ناشی از تخریب ایمونولوژیک و تهاجم سلولهای لنفوسیتی به سلولهای بتای پانکراس است. این پروسه تخریبی ماهها یا سالها قبل از شروع علائم بالینی رخ میدهد. با تخریب ۸۰ تا ۹۰ درصد حجم سلولهای بتا، علائم دیابت ظاهر میشود. سرعت تخریب سلولهای پانکراس متغیر بوده ولی در کودکان سرعت بیشتری نسبت به بزرگسالان دارد. حضور اتوآنتیبادیهای گوناگون در سرم بیماران ممکن است سالها قبل از بروز هایپرگلیسمی رخ دهد؛ برای مثال آنتیبادیهای علیه اجزای سیتوپلاسمی سلولهای جزایر (ICAs) در ۷۵ تا ۸۵ درصد دیابت نوع اول رخ میدهد و یا اتوآنتیبادی علیه انسولین در ۹۰ درصد موارد قبل از پنج سالگی از شروع دیابت و در ۴۰ درصد موارد پس از بروز دیابت در ۱۲ سالگی قابل تشخیص است.
آنتیبادی علیه ایزوفرم ۶۵ کیلودالتون از گلوتامیک اسید دکربوکسیلاز (GAD۵۶) حتی تا ۱۰ سال قبل از شروع علائم بالینی دیابت تایپ یک ظاهر گردیده و در حدود ۶۰ درصد بیماران در بدو تشخیص دیابت قابل تشخیص است. با شناسایی آنتیبادیهای (GAD۵۶) ممکن است بتوان آن دسته از بیماران مبتلا به دیابت نوع دو که متعاقباً به دیابت نوع یک مبتلا میشوند را شناسایی کرد.
در حدود ۵۰ درصد موارد دیابت تایپ یک آنتیبادی علیه آنتیژن در همراهی با انسولینوما (IA-۲A,IA-۲B) شناسایی گردیده است. در سال ۲۰۰۷ اتوآنتیژنی به نام زینک ترانسپورتر یا ZnT۸ کشف گردید که آنتیبادی علیه آن تقریباً در ۲۶ درصد موارد تایپ یک که برای آنتیبادیهای دیگر منفی بودهاند، یافت شده است. ژنهای زیادی در اتیولوژی دیابت نوع یک از قبیل محل ژنهای کدکننده آنتیژنهای بافتی، ژن انسولین، HLA-Dr۳ و HLA-Dr۴ و … مطرح شدهاند.

اگر فرزند شما دچار تشنگی شدید، خستگی، اختلال بینایی، کاهش وزن سریع و تکرر ادرار است حتماً به پزشک برای بررسی دیابت مراجعه گردد
مانیتورینگ قند:
آستانه دفع قند از ادرار، قند خون ۱۶۰ تا ۱۸۰ میلیگرم در دسیلیتر است اما دارای تفاوت وسیع در افراد است. افزایش سطح آستانه در بیماران با دیابت طولانی مدت و یا کاهش سطح آستانه در حاملگی و بچهها ممکن است مشاهده شود. دفع قند ادرار با آستانه قند خون ۱۰۰ میلیگرم در دسیلیتر بهعنوان گلوکزاوری کلیه شناخته میشود. پیگیری قند ادرار دارای حساسیت نیست، در یک مطالعه بیماران با قند بین ۱۵۰ تا ۱۹۹ دارای آزمایش منفی ادرار و در مواردی با قند کمتر از ۱۴۹ دارای آزمایش مثبت ادرار بودهاند.
فاکتورهای مختلفی از قبیل غلظت ادرار، مایعات، آسکوربیک اسید، عفونتهای ادراری روی نتایج قند ادرار اثر میگذارد. استفاده از گلوکومتر که در خانه استفاده میشود گرچه برای کنترل و نه برای تشخیص رل مهمی دارند، ولی دارای منابع خطاهای مربوط به خود هستند؛ برای مثال میزان هماتوکریت بالا، کمخونی، چربی، رطوبت محیط و عدم هماهنگی بین گلوکومترها حتی در یک شرکت سازنده از عوامل مداخلهگر در تعیین قند خون است.
استفاده از گلوکومتر که در خانه استفاده میشود گرچه برای کنترل و نه برای تشخیص رل مهمی دارند، ولی دارای منابع خطاهای مربوط به خود هستند
دیابت تیپ ۲:
دیابت تایپ ۲ شایعترین نوع دیابت و حدود ۹۰ درصد کل موارد را شکل میدهد. شروع دیابت تدریجی بوده و بیماران دارای علائم حداقل هستند. بیشتر بیماران عوارض جبرانناپذیر در بدو تشخیص دارند. بیماران هم مقاومت به انسولین و هم کاهش ترشح انسولین دارند؛ تشخیص مقاومت به انسولین مشکل است و در بدو تشخیص بیماران ممکن است سطح نرمال، افزایش یا کاهش انسولین داشته باشند. عوامل ژنتیکی و محیطی در بروز دیابت مؤثر است، گرچه ژنهای متعددی مطرح شدهاند ولی هنوز نتیجه رضایتبخش نبوده است. چاقی در ارتباط با دیابت تایپ ۲ است و افراد چاق که اعضای خانواده سابقه دیابت دارند ۱۰ برابر در خطر هستند. ورزش و کاهش وزن بروز دیابت را به تعویق میاندازد. ارتباط معکوس بین فعالیت فیزیکی و دیابت تایپ دو برقرار است. هر کاهش ۵۰۰ کیلوکالری انرژی، حدود ۶ درصد ریسک دیابت تایپ دو را کاهش میدهد. سلولهای بتای پانکراس در محیطی با پلاسمای چرب قادر به ترشح کافی انسولین نیستند.
کتو اسیدوز:
فرآیند کتو اسیدوز نیاز به تغییراتی در بافت چربی و کبد دارد. سوبسترای عمده برای اجسام کتونی، اسیدهای چرب ذخیره در بافت چربی است. مغز برخلاف سایر بافتهای بدن توانایی استفاده از اسیدهای چرب را ندارد و چنانچه سلولهای مغز به علت فقدان انسولین نتوانند قند را از خون برداشت کنند، منبع تولید انرژی برای مغز اجسام کتونی است.
در دیابت کنترلنشده سطح پایین انسولین موجب لیپولیز گردیده و افزایش نسبت گلوکاگون به انسولین موجب اکسیداسیون اسیدهای چرب در کبد میگردد. استواستات، هیدروکسی بوتیرات و کتون از اجسام کتونی هستند. در دیابت شدید نسبت بتا هیدروکسی بوتیرات به استواستات ممکن است شش به یک باشد و این به علت حضور غلظت بالای NADH است.
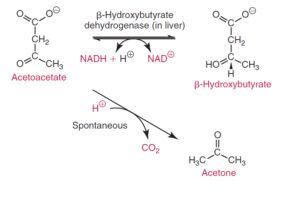
تقریباً هیچکدام از روشهای آزمایشگاهی قادر به تشخیص تمام اجسام کتونی نیست. معرف فریککلراید (gerhardt) تنها با استواستیک واکنش میدهد. سدیم نیتروپروساید حداقل ۱۰ بار حساستر برای استواستات نسبت به استون است و واکنش با هیدروکسی بوتیرات ندارد و این ممکـــن است با یک پارادوکس در درمان کتواسیدوز روبرو شود؛ برای مثال در بیمار دیابتی که با کتواسیدوز مراجعه میکند ممکن است در ابتدا سطح کتون کم باشد ولی با درمان دیابت سطـــــــح آن بالا رود و این به علت تبدیل بتاهیدروکسیبوتیرات به استواستات است.
گرسنگی طولانی مدت، استفراغ طولانی، دیابت و بیماریهای ذخیرهای کلاژن تایپ یک موجب کتواسیدوز و کتوناوری میگردند. مصرف غذاهای پرچرب با کربوهیدرات کم نیز کتوژن است. دیابت در همراهی با مصرف الکل علت مهم کتواسیدوز در بالغین است. تست کتون ادرار در ۳۰ درصد خانمهای حامله در ادرار اول صبح مثبت است.
قرصهای استوتست حاوی مخلوطی از گلایسین، سدیم نیتروپروساید، فسفات دایسدیم و لاکتوز است. استواستات و به میزان کمتر استون در حضور گلایسین رنگ بنفش با نیتروپروساید میدهد. نتایج مثبت کاذب در حضور فنول کتونها، داروهای سولفهیدریل از قبیل بازدارندههای آنژیوتانسین مانند کاپتوپریل، انالاپریل و نیز متابولیتهای الدوپا رخ میدهند.
سنجش اجسام کتونی در ادرار یا خون برای پیگیری دیابت تایپ یک بهویژه با قند بیشتر از ۳۰۰ میلیگرم در حضور بیماری یا استرس و نیز در پیگیریهای دیابت حاملگی با سابقه قبلی دیابت و یا دیابت حاملگی صورت میگیرد.
روشهای قدیمی برای سنجش بتاهیدروکسی، جوشاندن ادرار برای تبخیر استون و استواستات و اکسید کردن هیدروکسی بوتیرات به استواستات و سنجش استواستات توسط معرف gerhardt بوده است، اما امروزه میتوان بتا هیدروکسی بوتیرات که ارتباط بیشتری با وضعیت کتواسیدوز دارد را طبق فرایند زیر مورد سنجش قرار داد.
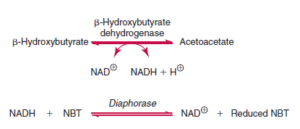
سطح هیدروکسی بوتیرات بین ۰/۲۱ الی ۲/۸۱ میلیگرم درصد در افراد در صبح ناشتا است. سطح اجسام کتونی ممکن است به ۲۰ میلیگرم درصد با ورزش طولانیمدت برسد. در بیماران دیابتی با کتواسیدوز سطح بتاهیدروکسی غالباً بالای ۲۰ میلیگرم درصد است. با نوارهای Ketostix که از معرف نیتروپروساید استفاده میکنند، واکنش کتون زمانی مثبت میشود که حداقل ۵۰ میلیگرم در لیتر استواستات وجود داشته باشد و با چارت رنگی میتوان غلظتهای مختلف از ۵۰ تا ۱۶۰۰ میلیگرم در لیتر را شناسایی کرد.
فروکتوزآمین:
فروکتوزآمین یک نام کلی برای پیوند کتوآمینی گلوکز با پروتئینهای خون بهویژه آلبومین است. گرچه از سنجش فروکتوز آمین در کنترل دیابت بهویژه در آن دسته که سنجش HbA۱C دقیق نیست میتوان استفاده کرد، ولی در مقایسه با HbA۱C که با آن میتوان به کنترل طولانی مدت دیابت دست یافت، سنجش فروکتوزآمین کنترل یک ماهه (در حدود ۲۵ درصد طول زمانی HbA۱C) را تحت پوشش قرار میدهد. سنجش فروکتوزآمین در سندرم نفروتیک، سیروز کبد، اختلالات پروتئینی، تغییرات ناگهانی در پروتئینهای فاز حاد، افزایش پروتئینهای سرم قابل اعتماد نیست. سنجش فروکتوز با سطح آلبومین کمتر از ۳ گرم درصد سفارش نمیشود.
. 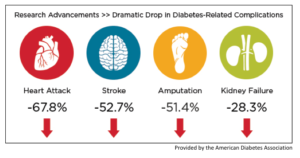
با کنترل دقیق دیابت میتوان عوارض قلبی عروقی، سکته مغزی، قطع اندام و نارسایی کلیه را با توجه به شکل فوق با درصد قابل چشمگیری کاهش داد
هایپوگلایسمی
چنانچه با آزمایشهای مکرر هایپوگلایسمی یا قند کمتر از ۶۰ میلیگرم در هر دسیلیتر مشاهده شود، ممکن است به علت افزایش حساسیت به انسولین یا انسولینمی (Insulinemia) باشد. برای تأیید تشخیص هایپوگلایسمی نیاز به تست OGT یا تست تحمل گلوکز ۵ ساعته است زیرا گاهی افت گلوکز به کمتر از ۶۰ میلیگرم بعد از سه ساعت رخ میدهد. در هنگام انجام تست OGT در بیماران هایپوگلایسمی بایستی احتیاط فراوان صورت گیرد زیرا قند خوراکی ممکن است با افزایش شدید انسولین و هیپوگلیسمی واکنشی همراه شده و در نتیجه موجب عدم هوشیاری و گاهی شوک گردد و ازاینرو بایستی بیمار را زیر نظر گرفت.
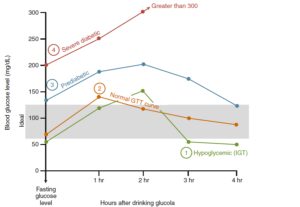
سطح گلوکز در آزمایش تحمل گلوکز در افراد نرمال، پرهدیابت، افراد هایپوگلیسمی و افراد دیابتیک
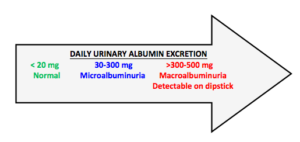
اندازهگیری میکروآلبومین برای پیگیری آسیب به کلیه ناشی از دیابت و یا پرفشاری اهمیت دارد. در بیماران دیابتی اولین آسیبی که به کلیه وارد میشود مثبت شدن میکروآلبومینیوری است. در بیماران پرفشار، مثبت شدن میکرو آلبومین ارتباط با هیپرتروفی بطن چپ دارد. دفع ادراری ۳۰ تا ۳۰۰ میلیگرم در ادرار ۲۴ ساعته را میکروآلبومیناوری گویند و یا به دفع ۳۰ تا ۳۰۰ میکروگرم آلبومین به ازای دفع هر میلیگرم کراتینین در ادرار راندوم، نیز میکروآلبومیناوری گفته میشود. دفع ادراری بیشتر از ۳۰۰ میلیگرم آلبومین در ادرار ۲۴ ساعته را پروتئیناوری گویند
- - نشانی ایمیل شما منتشر نخواهد شد.
- - لطفا دیدگاهتان تا حد امکان مربوط به مطلب باشد.
- - لطفا فارسی بنویسید.
- - میخواهید عکس خودتان کنار نظرتان باشد؟ به gravatar.com بروید و عکستان را اضافه کنید.
- - نظرات شما بعد از تایید مدیریت منتشر خواهد شد

