روشهای کنترل کیفیت در قارچشناسی کلینیکی
مقدمه و کلیات
از آنجا که سلولهای قارچی بسیار بزرگتر از باکتریها هستند، در مقادیر و تعداد اندکی در بافت حضور دارند و با توجه به ماهیت رشتهای آنها، در یک ارگان یا ارگانهای اندکی و نیز در بخشهای محدودی از آن ارگانها لوکالیزه میشوند. پیرو این مسئله هنگامیکه بافت مورد امتحان قرار میگیرد، ضروری است که نواحی متعددی از نمونه انتخاب شود و در مورد مایعات بدن (مثل خلط) هر جا که لازم است ابتدا هموژنیزه شوند و به کمک سانتریفیوژ تغلیظ گردند. دقت در تهیهی نمونه و شکیبایی و پیگیری در طول مدت مشاهدهی میکروسکپی، اساس یک تکنیک خوب در آزمایش میکروسکپی برای قارچها است. مهمترین ویژگی آزمایش مستقیم، سرعت عمل آن است.
در بسیاری از موارد مربوط به ناخن، نمونهی مستقیم میکروسکپی مثبت ولی کشت منفی میشود. از طرف دیگر هایفیهای غیرزنده گاهی اوقات در خلط بیماران مبتلا به آسپرجیلوما، در ناخن و در نمونههای بعد از مرگ در آزمایش میکروسکپی مشاهده میشوند.
کشت دارای فواید مهمی است: اولاً تکنیک بسیار حساستری است زیرا مقدار بیشتری از نمونهی بدست آمده به این وسیله مورد آزمایش قرار میگیرد و ثانیاً امکان انجام تست حساسیت به مواد ضدقارچی را فراهم میآورد.
تهیهی لام مستقیم با پتاس
هرچقدر لام تهیهشده برای میکروسکوپ نازکتر باشد شانس بیشتری برای یافتن عناصر قارچی در نمونه وجود خواهد داشت. پتاس در غلظتهای بین 10 تا 30 درصد بکار برده میشود. با افزودن DMSO فرآیند خیسخوردگی و نرم شدن کامل شده و نیازی به حرارت دادن یا منتظر ماندن برای مشاهدهی میکروسکپی نخواهد بود.
طرز تهیهی محلول KOH/DMSO
- 40 میلیلیتر از DMSO را به 60 میلیلیتر آب مقطر افزوده و خوب مخلوط کنید.
- ۲۰ گرم پتاس را وزن کرده و در محلول فوق حل کنید.
- محلول ساختهشده را در یک ظرف شیشهای دربدار نگهداری نمایید.
انتخاب ظرف مناسب برای کشت قارچها
انتخاب ظرف برای کشت قارچها به تعداد آزمایشهای قارچشناسی (workload)، نوع قارچهایی که در واحد آزمایشگاهی مربوطه بیشتر جدا میشوند و میزان خطر قارچهای جداشده برای پرسنل بستگی دارد. پتریدیشهای 9 سانتیمتری برای کشت قارچها مناسب و مطلوب هستند بدلیل اینکه نسبت به لوله یا ظروف دیگر میتوان مقادیر زیادتری از نمونه را روی آن کشت داد، دوم آنکه سطح بزرگتری از محیط در دسترس است که برای جداسازی کلنیهای قارچی از یکدیگر میتواند مورد استفاده قرار گیرد و بالاخره اینکه امکان هوادهی بهتری وجود دارد. در مواقعی که نیاز به انکوباسیون طولانی مدت برای جداسازی قارچهای کندرشد وجود دارد، 20 میلیلیتر آگار در پتریدیشهای 9 سانتیمتری استفاده میشود و پتریدیشها در یک کیسهی پلاستیکی (polythene) یا یک ظرف فلزی (metal canister) قرار داده میشوند.
آمادهسازی نمونهها
اصول کلی
اکثر نمونههایی که به آزمایشگاه میرسد برای آزمایش مستقیم و کشت مورد استفاده قرار میگیرند. اگر مقدار کل نمونه آنقدر کم باشد که نتوان هر دو آزمایش را انجام داد، تمام حجم نمونه را باید کشت داد زیرا کشت متد حساستری برای جداسازی قارچها میباشد.
هنگام دریافت، نمونه ابتدا بهصورت ماکروسکوپی مورد بررسی قرار میگیرد و از قسمتهایی از نمونه که نمایندهای از کل نمونه است آزمایش انجام میشود. نمونههای مو در موارد مشکوک به کچلیها ابتدا با چراغ وود مورد معاینه قرار داده میشوند و موهایی که فلئورسانس دارند برای آزمایش مستقیم و کشت انتخاب میشوند. در نمونههای خلط و بافت، قسمتهای پنیری شکل، چرکی، خونی، یا نکروتیک برای انجام آزمایش انتخاب میشوند.
نمونههای غیرمناسب
نمونههای غیرمناسب عبارتند از:
- موادی که با سواب خشک گرفته شده باشند.
- موادی که درون مواد فیکساتیو برای کشت فرستاده شدهاند.
- نمونههای خلط که عمدتاً از بزاق دهان تشکیل شدهاند.
- نمونههای خلط یا ادرار ۲۴ ساعت جمعآوریشده
- موادی که هنگام انتقال نشت کردهاند و آلوده شدهاند یا برای پرسنل آزمایشگاه خطرآفرین میباشند.
- نمونههایی که برای آماده شدن برای آزمایش میکروسکپی و کشت کافی نیستند.
- موادی که با تأخیر (گاهی تا چند روز) به آزمایشگاه رسیدهاند.
در تمام این موارد نمونهبرداری باید تکرار شود. در صورتی که بیمار در وضعیت اورژانس قرار داشته باشد و یا نمونهبرداری مجدد مشکل بوده و یا خطرناک باشد، آزمایشگاه باید آنچه را میتواند بر روی نمونهی موجود انجام دهد. اطلاعات ناکافی روی نمونه نباید معیار رد نمونه قرار گیرد زیرا با تماس تلفنی میتوان از طریق پزشک یا بخش مربوط این اطلاعات را بدست آورد.
آماده کردن نمونهها برای آزمایش
آمادهسازی نمونهها قبل از آزمایش میکروسکپی و کشت، اغلب کمککننده و گاهی نیز الزامی است؛ بعنوان مثال در مواردی که تعداد ارگانیسم قارچی در نمونه اندک است، برای افزایش آشکارسازی در آزمایش مستقیم میکروسکپی و کشت بکار میرود. استفاده از تکنیک آسپتیک بهمنظور اجتناب از آلودگی اهمیت دارد.
تغلیظ ارگانیسمها
نمونههای خاص مانند مایع مغزی نخاعی، ادرار و یا مواد آسپیره اغلب به تغلیظ نمونه نیاز دارد تا بازیابی مطلوب ارگانیسمها بدست آید. این کار بهطور معمول توسط سانتریفیوژ انجام میگیرد و سپس رسوب تهیهشده مورد بررسی قرار میگیرد. از تکنیک فیلتراسیون نیز میتوان استفاده کرد.
سانتریفیوژ
مقدار مشخصی از نمونه با دور 1500 به مدت 10 دقیقه سانتریفیوژ میشود و سپس مایع رویی دور ریخته شده و رسوب باقیمانده در حجم معینی سالین استریل (معمولاً 0/1 الی 0/25 میلیلیتر) مجدداً سوسپانسیون شده و سپس مورد آزمایش قرار گیرد. اگر حجم معینی از نمونه کشت شود نتایج را میتوان بهصورت کمی برحسب تعداد کلنی در واحد حجم (CFU/ml) بیان نمود.
فیلتراسیون
روش جایگزین برای تغلیظ قارچها در نمونههای مایع (از جمله خون) روش فیلتر کردن است و برای این کار از فیلترهای میلی پور (که اندازهی سوراخهای آن ۰/۴۵ میکرون است) استفاده میشود. بعد از فیلتر کردن، کاغذ فیلتر را روی محیط کشت قرار میدهیم و همچنین میتوان مواد را از روی فیلتر برداشته و مورد آزمایش میکروسکپی قرار داد. این تکنیکها علاوه بر اینکه احتمال بازیابی قارچها را افزایش میدهند همچنین میتوانند نسبت به حذف و برداشت مواد ضدقارچی موجود در نمونه کمک نمایند و در صورت لزوم نمونهی رسوب را میتوان با مقادیر دیگری سالین استریل مورد شستشو قرار داد تا از حذف کامل مواد ضدقارچی اطمینان حاصل نمود. روشهای تغلیظ دارای مخاطرات بالقوهای نیز هستند؛ به این صورت که در این تکنیکها ارگانیسمهای ناخواسته و یا بیربط نیز در نمونه تغلیظ میشوند، بعنوان مثال یک رشد سنگین باکتری یا مخمر میتواند رشد قارچهای رشتهای بااهمیت را تحت تأثیر قرار دهد.
سیال کردن و هموژنیزاسیون نمونهها
سیال کردن نمونههای غلیظ مثل خلط و هموژنیزه کردن نمونههایی مانند مدفوع و بافتها برای افزایش احتمال بازیابی قارچها بسیار کمککننده است و در مواقعی که قصد بدست آوردن نتایج کمی از کشت را داریم اقدامی اساسی است.
خلط
خلط را میتوان با حجمی مساوی از یک مادهی موکولیتیک مانند پانکراتین نیم درصد و یا ان- استیل- ال- سیستئین نیم درصد مخلوط نمود. نمونهی مخلوط در دمای اتاق قرار میگیرد تا بهصورت سیال درآید، سپس میتوان آن را سانتریفیوژ نموده و به این صورت ارگانیسمهای موجود در آن را برای کشت تغلیظ نمود.
مدفوع
نمونههای آبکی نیازی به آمادهسازی برای آزمایش میکروسکپی و کشت ندارند. در مورد نمونههای جامد ۰/۳گرم از نمونه را با کمک یک لوپ یکبار مصرف در ۳ میلیلیتر آب مقطر استریل هموژنیزه نموده و سپس با کمک دستگاه ورتکس کاملاً مخلوط کنید. رقتهای اعشاری بر مبنای یکدهم (دهم، بیستم، …) از سوسپانسیون مدفوع در آب مقطر استریل تهیه کرده و حجمهای معینی (۰/۱ تا ۰/۵ میلیلیتر) در محیط کشتهای داخل پلیت تلقیح نمایید.
بافت
قبل از آزمایش میکروسکپی و کشت با کمک اسکالپل و فورسپس استریل نمونههای بافت را به قطعات کوچکتر (به قطر نیم تا یک میلیمتر) خرد کنید. نمونههای بزرگتر را باید با کمک هاون و یا هموژنایزر به قطعات کوچکتر خرد نمود. البته این روش برای بازیابی زیگومیستها بدلیل طبیعت شکننده بودن آنها مناسب نمیباشد. به جهت کاهش ریسک آلودگی سطحی، نمونههای بافت را قبل از کشت دادن میتوان در یک محلول حاوی آنتیبیوتیک شستشو داد. آنتیبیوتیک مناسب برای این منظور جنتامیسین با غلظت ۵۰ میکروگرم در میلیلیتر است. شستشوی نمونه با آنتیبیوتیک بهویژه در مورد نمونههای بیوپسی بدستآمده از بیماران مشکوک به میکوزهای زیرجلدی مفید است زیرا آلودگی کشتها در اینجا یکی از مشکلات عمده است.
روشهای جستجوی آزمایشگاهی
آزمایش مستقیم میکروسکپی
آزمایش مستقیم میکروسکپی از نظر سرعت اهمیت دارد و اغلب منجر به یک تشخیص فرضی میگردد. در برخی موارد بر اساس نتایج آزمایش میکروسکپی درمان آغاز میشود. حساسیت و ویژگی آزمایش میکروسکپی به ۳ فاکتور بستگی دارد که عبارتند از:
- تعداد ارگانیسمهایی که در نمونه وجود دارند.
- نوع ارگانیسم قارچی
- تجربهی آزمایشگر
آزمایش استاندارد برای نمونههای پوست، مو، ناخن و نمونههای غشاءهای مخاطی استفاده از پتاس ۱۰ تا ۳۰ درصد است. هرچند که نمونههای مربوط به غشاءهای مخاطی را میتوان با تکنیکهای رنگآمیزی مثل گرم نیز رنگآمیزی نمود. برای بافتهای کراتینی بهویژه ناخن برای تسریع در تجزیهی کراتین، دیمتیل سولفوکساید ۴۰% اغلب بهصورت آمیخته با پتاس بکار گرفته میشود. نمونههای خلط و مایع مغزی نخاعی یا ادرار را میتوان بهطور مستقیم مورد آزمایش قرار داد، هرچند که بهتر است این نمونهها را با حجم برابر با پتاس مخلوط نمود تا عناصر قارچی بهصورت شفافتر نمایان گردند. توانایی تمیز دادن بین ساختمانهای قارچی و آرتیفکت در نمونهها نیاز به تجربه و مهارت دارد.
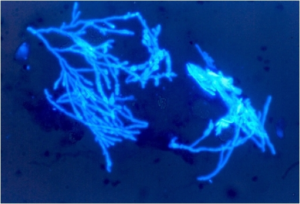
کالکوفلور سفید (رنگی که در اثر تحریک با نور ماوراء بنفش خاصیت فلئورسانس نشان میدهد) را نیز میتوان به پتاس افزود. این رنگ برای آشکارسازی قارچها در نمونه بسیار مفید است، بخصوص در مواقعی که تعداد ارگانیسم قارچی در نمونه اندک است اما ایراد آن این است که به میکروسکوپ فلئورسنت نیاز است. در وضعیتهای خاصی استفاده از پتاس برای آشکارسازی قارچها رضایتبخش نیست، بعنوان مثال اندازهی کوچک سلولهای مخمری هیستوپلاسما موجب میشود که بهسختی در نمونههای مرطوب دیده شود و در موارد مشکوک به هیستوپلاسموزیس گسترشهای رنگآمیزی شده با رنگ گرم از نمونههایی مانند خلط و چرک ترجیح داده میشوند. در موارد مشکوک به کریپتوکوکوزیس معمولاً لازم است مادهی مورد آزمایش (مثلاً CSF) در مرکب چین یا نیگروزین آزمایش شود. این تکنیک زمینهی تاریکی ایجاد میکند که برای مشاهدهی سلولهای مخمری کپسولدار کریپتوکوکوس نئوفرمنس ضروری است و با روشهای دیگر غیر از این، بهصورت آشکارنشده باقی میمانند.
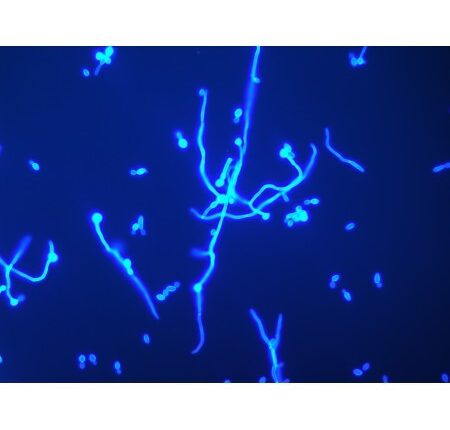
هایفیهای قارچ در نمونهی ناخن با کمک کالکوفلور سفید و میکروسکوپ ایمنوفلورسانس
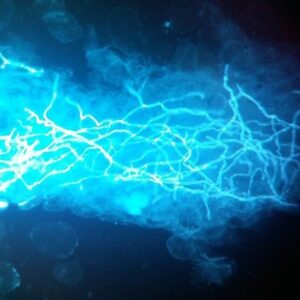
هایفیهای دارای تیغهی میانی درماتوفیت با کمک کالکوفلور سفید و میکروسکوپ ایمنوفلورسانس
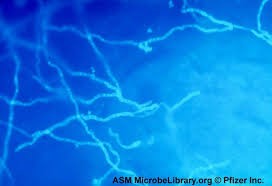
تراشههای قرنیه چشم با کمک کالکوفلور سفید و میکروسکوپ ایمنوفلورسانس
رنگآمیزی آنتیبادی فلئورسنت را نیز میتوان برای آشکارسازی قارچها در موارد کلینیکی بکار برد. این تکنیک نیز در مواردی که تعداد ارگانیسم قارچی در نمونه کم است مفید است، اگرچه استفاده از این تکنیک بدلیل محدودیت دسترسی به آنتیسرمهای اختصاصی چندان معمول نمیباشد.
کشت
جداسازی قارچهای پاتوژن در کشت عموماً مشکل نیست. نکات مهم در این زمینه عبارتند از:
1- شمارش ارگانیسمها. گاهی لازم است که مقادیر مشخصی از نمونه کشت شود. شمارش کلنی عناصر قارچی زنده برحسب CFU/ml انجام میگیرد. این کار در پیشگویی و پیگیری (پایش) دورهی بیماریهای خاصی مفید است، بعنوان مثال شمارش در نمونهی خلط برای آسپرجیلوزیس و کاندیدیازیس ریوی و شمارش در نمونهی مایع مغزی نخاعی برای کریپتوکوکوزیس حائز اهمیت است.
۲- انتخاب محیط کشت. تعدادی از محیطهای کشت برای قارچهای پاتوژن مناسب هستند. یک نیاز اساسی وجود منبع نیتروژن آلی است. محیطهای آگاردار به محیطهای آبگوشتی ترجیح داده میشوند بهاستثنای موقعی که کشت خون در کار باشد. انتخاب محیط کشت به نوع نمونه، بیماری مورد شک و سرانجام نظر یک مایکولوژیست بستگی دارد. یکی از معمولترین و شایعترین محیطهای کشت، سابورودکستروز آگار است اما اغلب اوقات نمونهها در محیطهای دیگر نیز کشت میشوند. محیطهای کشت اغلب با آنتیبیوتیکهایی مثل کلرآمفنیکل ۵۰ میلیگرم در لیتر بهمنظور به حداقل رساندن آلودگی باکتریال و سیکلوهگزامید (اکتیدیون) با غلظت نیم گرم در لیتر برای کاهش آلودگی با قارچهای ساپروفیت کاربردهای ویژهتری پیدا میکنند. برخی از پاتوژنها مانند آسپرجیلوس و هیستوپلاسما، هندرسنولا، کریپتوکوکوس و برخی گونههای کاندیدا توسط سیکلوهگزامید مهار میشوند. برای جداسازی و شناسایی سریع پاتوژنهایی خاص، از محیطهای ویژهای استفاده میشود، بعنوان مثال کریپتوکوکوس نئوفرمنس بر روی محیط کشتی که حاوی سوبسترا برای آنزیم فنیل اکسیداز است (محیط Niger seed extract یا dihydroxyphenylalanine) کلنیهای قهوهای رنگ تولید میکند.
انتخاب محیط کشت
شرایط مطلوب رشد کلنیهای قارچی
دمای مطلوب برای رشد اکثریت قارچهای پاتوژن حدود ۳۰ درجه است. بعنوان مثال قارچهای عامل کچلی در واقع در دمای ۳۷ درجه رشدی ندارند؛ بنابراین کشت مواد بدست آمده از میکوزهای سطحی و جلدی در دمای ۲۵ الی ۳۰ درجه صورت میگیرد. برای نمونههای مربوط به میکوزهای زیرجلدی و سیستمیک، پلیتها در دو دمای متفاوت یعنی ۲۵ الی ۳۰ درجه و نیز ۳۷ درجه باید انکوبه شوند.
انکوباسیون در دمای ۲۵ الی ۳۰ درجه سانتیگراد میزان دهیدراتاسیون محیط را نیز کاهش میدهد.
بیش از ۲۰ قطعه از نمونهای که قبلاً به ابعاد ۱ تا ۲ میلیمتر خرد شده است را در سطح آگار کشت دهید.
اگر به تریکوفیتون وروکوزوم مشکوک هستید پلیتها را علاوه بر دمای معمولی در دمای ۳۷ درجهی سانتیگراد نیز انکوبه نمایید.
آسپرجیلوس فومیگاتوس توانائی رشد در دمای ۴۵ درجه سانتیگراد را دارد که از این خاصیت برای تشخیص این قارچ از سایر کپکها استفاده میشود.

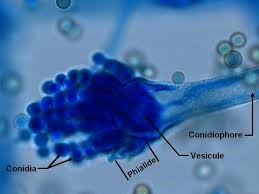
آسپرجیلوس فومیگاتوس
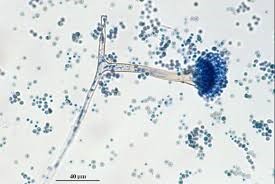
دستگاه زایشی آسپرجیلوس فومیگاتوس

کلنی آسپرجیلوس فومیگاتوس بر روی محیط سابورو، بعد از ۵ روز انکوباسیون در دمای ۳۰ درجه سانتیگراد
زمان آزمایش (بررسی) پلیتها
بسیاری از قارچهای پاتوژن رشد آهستهای دارند. در اکثر موارد ظرف ۷ تا ۱۰ روز نتایج مثبت کشتها حاصل میشوند. در مورد کاندیدا و آسپرجیلوس معمولاً بعد از ۱ تا ۳ روز کشتها مثبت میشوند.
هفتهای ۲ بار پلیتها باید مورد بررسی قرار گیرند
کشتهای منفی بعد از ۲ هفته نگهداری محیط کشت برای پوست، مو و مواد متفرقه و بعد از ۳ هفته برای ناخن گزارش میشوند.
به خاطر داشته باشیم که کشت نمونههای بیمارانی که تحت درمان با مواد ضدقارچی هستند نیز با کندی و بهآهستگی صورت میگیرد.
- - نشانی ایمیل شما منتشر نخواهد شد.
- - لطفا دیدگاهتان تا حد امکان مربوط به مطلب باشد.
- - لطفا فارسی بنویسید.
- - میخواهید عکس خودتان کنار نظرتان باشد؟ به gravatar.com بروید و عکستان را اضافه کنید.
- - نظرات شما بعد از تایید مدیریت منتشر خواهد شد