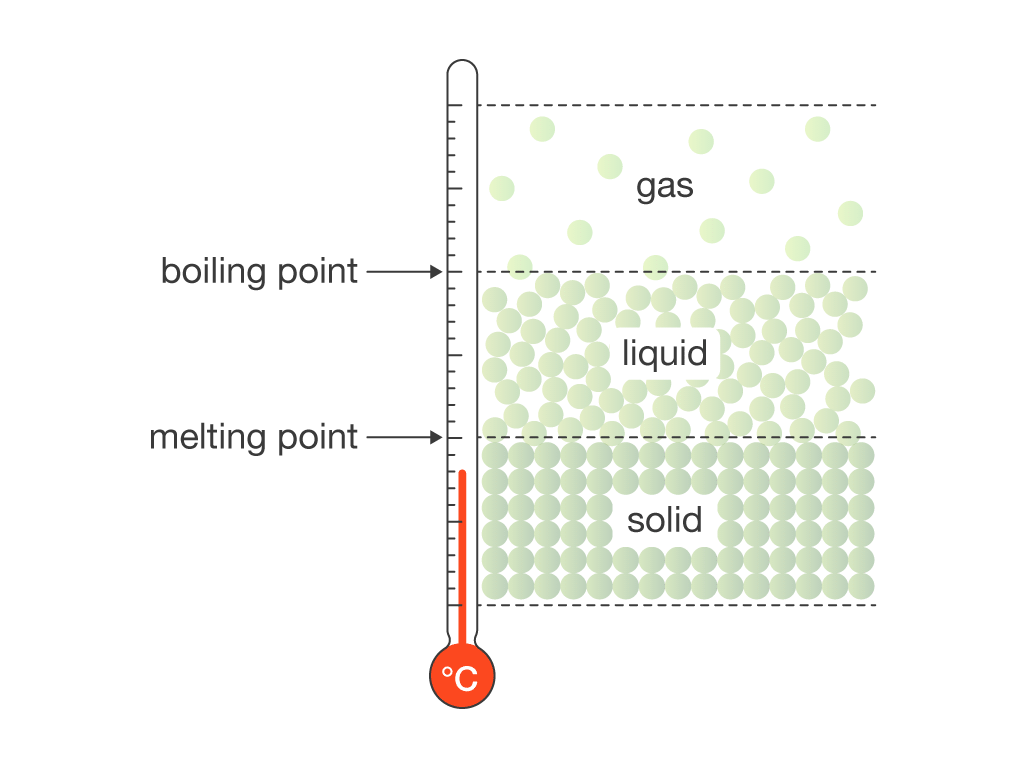
نقطه ذوب ویژگی مشخصه یک ماده بلوری است و دمایی است که در آن فاز جامد به فاز مایع تغییر می کند. این پدیده زمانی اتفاق می افتد که ماده گرم شود. در طی فرآیند ذوب ، تمام انرژی اضافه شده به ماده به عنوان گرمای همجوشی مصرف می شود و دما ثابت می ماند. در طول انتقال فاز ، دو فاز فیزیکی ماده در کنار هم وجود دارند.
بلورها از ذرات ریزی تشکیل شده اند که برای یک آرایش منظم و ۳ بعدی یک شبکه بلوری مناسب هستند. ذرات درون شبکه توسط نیروهای شبکه به هم چسبیده اند. وقتی ماده کریستالی جامد گرم شود ، ذرات انرژی بیشتری پیدا می کنند و با شدت بیشتری شروع به حرکت می کنند ، تا اینکه سرانجام نیروهای جاذبه بین آنها دیگر به اندازه کافی قوی نیستند تا بتوانند آنها را کنار هم نگه دارد در نتیجه ساختار بلوری از بین رفته و ماده جامد ذوب می شود.
هرچه نیروهای جاذبه بین ذرات قوی تر باشند ، انرژی بیشتری برای غلبه بر آنها لازم است. هرچه انرژی بیشتری لازم باشد یعنی نقطه ذوب بالاتر است. در ادامه مقاله توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
ویژگی های نقطه ذوب
هنگام ذوب نه تنها حالت کلی ماده تغییر می کند بلکه بسیاری از خصوصیات فیزیکی دیگر نیز به طور قابل توجهی تغییر می کنند. در این میان پارامترهای ترمودینامیکی ، ظرفیت حرارتی خاص ، آنتالپی و خصوصیات رئولوژیکی مانند حجم یا ویسکوزیته نیز تغییر خواهد کرد. آخرین ولی نه کم اهمیت ترین مورد ، تغییر ویژگی های نوری است. در مقایسه با سایر پارامترهای فیزیکی ، تغییر در انتقال نور به راحتی قابل تعیین است و بنابراین می تواند برای تشخیص دمای ذوب استفاده شود.
دمای ذوب یک ماده به فشار بستگی دارد و معمولاً در یک فشار استاندارد مانند ۱ اتمسفر یا ۱۰۰ کیلو پاسکال مشخص می شود. هنگامی که دمای ذوب به عنوان دمای تغییر معکوس از مایع به جامد در نظر گرفته می شود ، از آن به عنوان نقطه انجماد یا نقطه تبلور یاد می شود. به دلیل توانایی ابرخنک شدن مواد ممکن است نقطه انجماد کمتر از مقدار واقعی آن باشد.
اهمیت دانستن نقطه ذوب
دانستن دمای ذوب یک ماده شیمیایی برای ذخیره سازی و انتقال آن بسیار مهم است. شما احتمالاً نمی خواهید یک ماده جامد را در دمای نزدیک یا بالای نقطه ذوب آن ذخیره یا حمل کنید که در این صورت پس از ذوب شدن ممکن است دچار نشت شده و عواقب جبران ناپذیری داشته باشد.
علاوه بر این ، از نقطه ذوب اغلب برای پیش بینی رفتار تقسیم ماده شیمیایی بین فازهای جامد و گاز استفاده می شود. دمای ذوب بالاتر نشان دهنده نیروهای بین مولکولی قویتر و در نتیجه فشار بخار کمتر است.
آزمایش نقطه ذوب برای هر ماده شیمیایی لازم نیست ولی معمولاً در شرایط عادی برای مواد جامد انجام می شود. تحت آزمایشات مختلف اگر نقطه ذوب ماده بالاتر از ۳۰۰ درجه سانتیگراد باشد ، نیازی به آزمایش فشار بخار نیست.
مثال هایی از نقطه ذوب
برای بیشتر مواد ، نقاط ذوب و انجماد تقریباً برابر است. به عنوان مثال ، دمای ذوب و نقطه انجماد جیوه ۲۳۴.۳۲ درجه کلوین است با این حال ، برخی از مواد دارای دماهای مختلف انتقال مایع جامد هستند. به عنوان مثال ، آگار در دمای ۸۵ درجه سانتی گراد ذوب می شود و در دمای ۳۱ درجه سانتی گراد جامد می شود. چنین وابستگی به جهت به عنوان پسماند شناخته می شود. تفاوت نقطه ذوب و انجماد برخی از ترکیبات بسیار قابل توجه است.
دمای ذوب یخ در فشار اتمسفر ۱ بسیار نزدیک به ۰ درجه سانتی گراد است . در حضور مواد هسته دار ، نقطه انجماد آب همیشه با نقطه ذوب یکسان نیست. در غیاب هسته دار کننده ها آب می تواند به صورت مایع فوق سرد تا ۴۸.۳ – درجه سانتی گراد قبل از انجماد وجود داشته باشد.
بالاترین دمای ذوب مربوط به تنگستن با دمای ذوب ۳.۴۱۴ درجه سانتی گراد است و همین ویژگی باعث می شود تنگستن برای استفاده به عنوان رشته در لامپ ها عالی باشد. کربن غالباً در فشار محیط ذوب نمی شود بلکه در حدود دمای ۳۷۰۰ درجه سانتی گراد ذوب می شود.
کاربید هافنیوم تانتالوم (Ta4HfC5) یک ترکیب نسوز با دمای ذوب بسیار بالا حدود ۴۴۰۰ کلوین است. شبیه سازی های مکانیک کوانتومی پیش بینی کرده اند که آلیاژ HfN0.38C0.51 حتی از دمای ذوب بالاتری نیز برخوردار خواهد بود که آن را به ماده ای با بالاترین دمای ذوب در فشار محیط تبدیل می کند.
فاکتورهای موثر بر نقطه ذوب
ترکیب مولکول ها
وقتی مولکول ها با پیوندهای محکم در کنار هم قرار بگیرند دمای ذوب بالاتری نسبت به ماده ای با مولکول هایی با پیوند غیر محکمی خواهند داشت. به عنوان مثال دمای ذوب مولکول های نئوپنتان متقارن بالاتر از ایزوپنتان است که در آن مولکول ها پیوند مستحکمی ندارند.
اندازه مولکول ها
اندازه مولکولی نیز بر روی دمای ذوب تأثیر می گذارد. وقتی سایر فاکتورها برابر باشند ، مولکول های کوچکتر در دمای پایین تری نسبت به مولکول های بزرگ ذوب می شوند. به عنوان مثال ، نقطه ذوب اتانول ۱۱۴.۱ – درجه سانتی گراد است در حالی که دمای ذوب مولکول اتیل سلولز بزرگتر ۱۵۱ درجه سانتی گراد است.
ماکرومولکول ها دارای ساختارهای غول پیکر ساخته شده از بسیاری از اتمهای غیر فلزی هستند که توسط پیوندهای کووالانسی به اتمهای مجاور پیوسته اند. مواد دارای ساختار کووالانسی غول پیکر ، مانند الماس ، گرافیت و سیلیس ، دارای دمای ذوب بسیار بالایی هستند زیرا قبل از ذوب شدن باید چیدمان قوی پیوند کووالانسی آنها شکسته شود.
نیروی جاذبه بین مولکولی
جاذبه شدید بین مولکول ها منجر به دمای ذوب بالاتر می شود. به طورکلی ترکیبات یونی دارای نقاط ذوب بالایی هستند زیرا نیروهای الکترواستاتیک متصل کننده یونها – برهم کنش یون و یون – قوی هستند. در ترکیبات آلی ، وجود قطبیت ، به ویژه پیوند هیدروژنی معمولاً منجر به دمای ذوب بالاتر می شود. نقاط ذوب مواد قطبی بالاتر از نقاط ذوب مواد غیر قطبی با اندازه های مشابه است. به عنوان مثال ، نقطه ذوب مونوکلرید ید که قطبی است ، ۲۷ درجه سانتیگراد / ۶/۸۰ درجه فارنهایت است ، در حالی که دمای ذوب برم ، یک ماده غیر قطبی ، ۷.۷ درجه سانتیگراد / ۱۹.۰۴ درجه فارنهایت است.
ناخالصی ها
مواد جامد ناخالص در دمای پایین ذوب می شوند و همچنین ممکن است در محدوده دمایی گسترده تری ذوب شوند که به عنوان افت دمای ذوب شناخته می شود. دامنه نقطه ذوب برای جامدات خالص باریک است ، معمولاً فقط ۱ تا ۲ درجه سانتی گراد است که به عنوان یک دمای ذوب شارپ شناخته می شود.
ناخالصی ها باعث نقص ساختاری می شوند که غلبه بر فعل و انفعالات بین مولکولی در مولکول ها را آسان می کند. یک دمای ذوب شارپ غالباً گواه خالص بودن نمونه است و دامنه ذوب وسیع نیز گواه خالص نبودن آن است. به عنوان مثال ، یک کریستال آلی خالص مولکولهای یکنواختی دارد که کاملاً در کنار هم قرار گرفته اند. با این حال ، کریستال ها وقتی در مخلوطی از دو مولکول آلی مختلف ظاهر می شوند غیر خالص هستند زیرا به خوبی با هم جور در نمی آیند. اکنون می دانید که چرا ناخالصی باعث کاهش نقطه ذوب می شود و این روند در نقطه ذوب فلزات کاملا قابل مشاهده است.
کاربرد نقطه ذوب
از آنجایی که دمای ذوب یک ثابت فیزیکی محسوب می شود از آن می توان برای مشخص کردن جامدات ناشناخته استفاده کرد. مثلا زمانی که در حال بررسی فرآورده های یک واکنش شیمیایی هستیم، می توان از بررسی دمای ذوب برای شناخت نوع ماده بدست آمده استفاده کرد.
از نقطه ذوب در صنایع نیز استفاده می شود به عنوان مثال با دانستن نقطه ذوب مواد مختلف می توان فرآوری سنگ های معدنی و تولید فلزاتی مانند طلا، مس، آلومینیوم و آهن را راحت تر انجام داد.
اندازه گیری نقطه ذوب
تکنیک های آزمایشگاهی زیادی برای تعیین نقاط ذوب وجود دارد. معمول ترین روش اندازه گیری، روش مویینگی (Capillary Method) که با قرار دادن نمونه در یک لوله مویین و حرارت دادن آن تا رسیدن به نقطه ذوب انجام می شود.
در روش های جدیدتر از ابزاری به نام دستگاه نقطه ذوب (Melting Point Apparatus) استفاده می شود که از روندی مانند لوله مویین بهره می گیرد. این دستگاه ها در انواع و اشکال مختلف در دسترس هستند.
با یک روش استاندارد یک ماده جامد به سرعت گرم شده و یک تخمین سریع از دمای ذوب آن بدست می آید که توسط دو دستگاه با نام های Mel-Temp و Fisher-Johns انجام می شود.
از نکات مهم در آزمایش تعیین نقطه ذوب این است که قبل از استفاده دستگاه حتما لوله ها را تمیز کنید تا نقطه ذوب را دقیق تر نشان دهد. برای اندازه گیری دمای ذوب نباید نمونه ها را دوباره ذوب کنید و همواره از نمونه تازه و لوله مویین جدید استفاده کنید. از لولههای مویین یکسان استفاده کنید زیرا لوله های مویین مختلف را نمی توان دوبار استفاده کرد.
تاثیر فشار اتمسفر روی نقطه ذوب
تاثیر فشار اتمسفر روی دمای ذوب بسیار جزئی است. با اینحال افزایش فشار باعث می شود ذرات جامد به یکدیگر نزدیک تر شوند و به این ترتیب نیروی بین مولکولی افزایش می یابد بنابراین دمایی که برای جدا کردن مولکول ها لازم است کمی بالا می رود.
ولی چون ذرات جامد در حالت عادی به هم نزدیک هستند و قابلیت تراکم چندان زیادی ندارند، تغییر فشار خارجی نمی تواند تغییر زیادی در دمای ذوب جامدات ایجاد کند به استثنای بعضی از مواد مانند یخ که با افزایش فشار نقطه ذوب آن کاهش می یابد.