اسیدها از ترکیبات شیمیایی هستند که کاربرد آن ها در واکنش های شیمیایی بسیار دیده می شود. اسید ها به دلیل خواص و نحوه عملکردشان در بخش های مهمی از زندگی روزمره و صنعت کاربرد دارند. نیترو اسید نیز همانطور که از نامش پیداست ترکیبی شیمیایی و دارای قدرت اسیدی است. از خواص نیترو اسید می توان به مایعی کم رنگ بودن و خواص اسیدی ضعیفش اشاره نمود. کاربرد نیتروس اسید در واکنش های اکسایش-کاهش نیز دیده می شود. انواع نیترو اسید در خلوص و گرید های مختلف در بازار مواد شیمیایی عرضه می گردد. در مصرف نیترو اسید و اسید های دیگر باید جوانب احتیاط را کاملا رعایت نمود.
در ادامه این مطلب به بررسی خواص و ویژگی های این ماده می پردازیم.
نیتروس اسید چیست
نیترو اسید یکی از اکسی اسید های نیتروژن محسوب می شود. این ماده ترکیبی بی رنگ تا کمرنگ با بویی تند است و یک اکسید کننده قوی بشمار می آید. این اسید ضعیف قادر به انجام واکنش های اکسایش کاهش بوده و در این واکنش ها استفاده می شود. محلول نیرو اسید دارای pH کمتر از خواهد بود.
نیترو اسید قوی یا ضعیف
نیترو اسید درواقع اسیدی ضعیف است که محلول آن دارای پی اچ کمتر از است. زیرا این اسید قادر است با از دست دادن یون هیدروژن طبق معادله زیر به یون نیتریت تبدیل گردد.
–HNO۲ → H+ + NO2
یونش نیترو اسید
از خواص نیترو اسید داشتن مولکول های قطبی است. نیروی جاذبه بین مولکول ها نیز از جنس نیروی جاذبه دوقطبی-دوقطبی است. در ساختار این ماده پیوند های هیدروژنی نیز دیده می شود، زیرا ساختار مولکول های این اسید به صورت توالی از HONO می باشد. اتم هیدروژن موجود در مولکول نیترو اسید دچار کمبود الکترون بوده و اندکی هم بار مثبت دارد. بنابراین قادر است پیوندی هیدروژنی با اکسیژن متصل به نیتروژن مولکول کناری برقرار نماید. ویژگی نیترو اسید این است که به خوبی در آب و حلال های قطبی دیگر حل خواهد شد. این ماده در آب یونیزه شده و یون های +H و – NO۲ را ایجاد می کند.
فرمول شیمیایی نیترو اسید
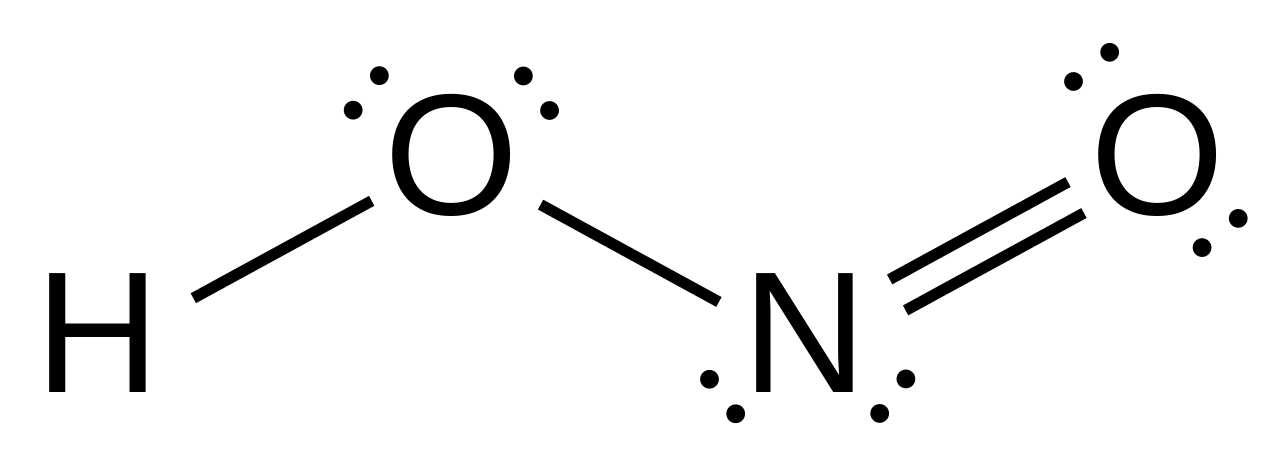
این اسید با فرمول HNO2 شناخته می شود. از دیگر نام های آن نیتروس اسید است. همان طور که قبلا هم اشاره کردیم این ماده دارای توالی اتم هایی به شکل HONO است. ساختار پیوندی این اسید را می توان به شکل H-O-N=O نشان داد. با توجه به این ساختار نیتروژن از هیبریداسیون sp۲ و اتم های اکسیژن از هیبریداسیون sp۳ برخوردارند. در این مولکول صورت بندی های مختلفی به شکل ترانس و سیس دیده می شود. چرخش حول پیوند H-O موجب ایجاد انواع این صورت بندی های مختلف شده است که البته فرم ترانس پایداری بیشتری هم دارد. دلیل پایدار بودن فرم ترانس نسبت به فرم سیس هم دافعه کمتر ابر الکترونی پیوندهای H-O و N=O در فرم ترانس است. اختلاف الکترونگاتیوی بین اتم های پیوندی و ساختار نامتقارن مولکول نیترواسید موجب شده است تا این ماده به عنوان یک مولکول قطبی در نظر گرفته شود.
سنتز نیتروس اسید
با حل شدن دی نیتروژن تری اکسید در آب می توان اقدام به تولید اسید نیترو نمود.
از واکنش نیتریت سدیم با اسیدهای معدنی مانند اسید کلریدریک و اسید هیدروبرمیک نیز می توان اقدام به تولید این اسید نمود.
شرایط واکنش دمای پایین بوده و اسید نیتروژن باید به سرعت مصرف گردد.
نیترو اسید اکسنده یا کاهنده
اسید نیتروژن علاوه بر اینکه عامل کاهنده است قادر است در فرآیندهای اکسیداسیون نیز دخالت کند.
این که این ماده اکسنده باشد یا کاهنده بستگی به اسیدیته محیطی دارد که واکنش در آن رخ خواهد داد.
کاربرد اسید نیترو
کاربرد اسید نیترو در تولید نمک های دی آزونیوم در صنعت استفاده می شود. واکنش این اسید با آمین های آروماتیک و فنول ها به ایجاد نمک دی آزونیوم می انجامد.
نمک های دیازونیوم در بسیاری از واکنش های آلی برای سنتز ترکیبات مورد استفاده قرار می گیرند.
نمک های دیازونیوم کاربرد های صنعتی گسترده ای دارند. آن ها می توانند ترکیبات آزوی درخشان ایجاد کرده و به عنوان رنگ دهنده استفاده شوند. استفاده از این ترکیبات به عنوان یک آزمایش کیفی برای تشخیص حضور آمین های آروماتیک صورت می پذیرد.
برای حذف آزید سدیم (NaN) از کاربرد نیترو اسید استفاده می شود. این ماده به طور بالقوه به دلیل تمایل به منفجر شدن خطرناک است.
از خواص اسید نیتروژن این است که قادر به واکنش با گروه های کتونی است که محصول واکنش اکسیم خواهد بود. این ترکیبات قابل اکسید نمودن بوده و می توان اسید های کربوکسیلیک از آن ها ایجاد نمود. همچنین می توان آن ها را به شکل آمین کاهش داد.
در تهیه تجاری اسید آدیپیک به عنوان مونومر مورد استفاده در تولید نایلون استفاده می شود.
این ماده در تولید پلی اورتان نقش داشته و استرهای آن نرم کننده هستند.
این ماده به همراه تیو سولفات سدیم برای درمان وریدی بیماران مسموم شده با سیانید سدیم نیز کارایی دارد. اما این روش عاملی جهش زا بوده که می تواند از طریق محلول زدایی اکسیداتیو سیتوزین و آدنین به جایگزینی در پایه های DNA منجر شود.
کاربرد این ماده به دلیل رفتار دوگانه آن نیز صورت می پذیرد. این ماده هم به عنوان یک ماده اکسیداتیو و هم به عنوان یک عامل کاهنده رفتار می کند.
کاربرد در صنایع غذایی
البته استفاده های تجاری کمی برای این ماده وجود دارد. این اسید به صورت نیتریت برای نگهداری گوشت به کار می رود. این ماده از رشد باکتری ها جلوگیری کرده و قادر به واکنش با میوگلوبین است که موجب رنگ قرمز تیره ای در گوشت خواهد شد. این رنگ گوشت برای مصرف جذاب تر بوده و به فروش بیشتر محصول می انجامد.
خطرات نیتروس اسید
با توجه به خواص شیمیایی این ماده اطلاعات کاملی در مورد اثرات سمی مستقیم آن وجود ندارد. اما برخی از آزمایشات و مشاهدات خطرات و عواقبی در مصرف این ماده معرفی نموده اند.
HNO2 اسیدی ضعیف است و می تواند بر روی دستگاه تنفسی اثرات مضری داشته باشد. این ماده علائم تحریک کننده ای را در بیماران مبتلا به آسم ایجاد خواهد نمود.
ترکیب فوق می تواند توسط دی اکسی هموگلوبین به صورت نیتریت سدیم کاهش یابد و تولید نیتریک اکسید کند که یک گشاد کننده عروق قدرتمند است. این ماده موجب شل شدن عضلات صاف عروق خواهد شد.
سمیت نیتریت سدیم نیز با فروپاشی قلبی عروقی و به دلیل عمل گشادکننده عروق و به دنبال آن افت فشار خون شدید تولید شده از نیتریت خود شناخته شده است.
دی اکسید نیتروژن موجود در هوای آلوده قادر است تحت شرایطی خاص تولید نیترو اسید کند. ترکیب این ماده با آمین ها و ترکیبات دیگر موجب افزایش ابتلا به بیماری سرطان خواهد شد.
در رابطه با دود سیگار نیز فرآیندی مشابه آنچه توضیح داده شد، رخ می دهد.
ایمنی نیتروس اسید
هنگام کار با این ماده باید از ماسک، دستکش و عینک های ایمنی استفاده شود.
این ماده قابل اشتعال است و در صورت اشتعال دود سمی ایجاد می کند. بنابراین باید از آتش گرفت آن ممانعت نمود. در صورت آتش برای اطفا حریق ناشی از آن می توان فوم، پودر خشک و کربن دی اکسید را بکار برد.
از قرار دادن این ماده در کنار اکسیدانت های قوی، بازها و عوامل احیا کننده قوی ممانعت نمایید.
در صورت برخورد تصادفی با نقاط مختلف بدن به سرعت محل برخورد را با آب فراوان شست و شو دهید.
سخن آخر
در این مقاله به بررسی خواص و ویژگی ها و کاربرد نیترواسید پرداختیم. ترکیبات شیمیایی در صورتی که درست استفاده شوند می توانند نقش موثری را در زندگی بشر ایفا کنند. اما در صورت عدم توجه در هنگام مصرف می توانند عواقب جبران ناپذیری را در افراد ایجاد نمایند. بنابراین در حین استفاده از اسید نیترو و ترکیبات مشابه باید جوانب احتیاط را رعایت نمود.
- - نشانی ایمیل شما منتشر نخواهد شد.
- - لطفا دیدگاهتان تا حد امکان مربوط به مطلب باشد.
- - لطفا فارسی بنویسید.
- - میخواهید عکس خودتان کنار نظرتان باشد؟ به gravatar.com بروید و عکستان را اضافه کنید.
- - نظرات شما بعد از تایید مدیریت منتشر خواهد شد